血流感染(BSI)是危及人类生命健康的全身性感染疾病,可导致菌血症、败血症和脓毒症,严重者可引起休克、弥散性血管内凝血(DIC)、多脏器功能衰竭乃至死亡。以大肠埃希菌和肺炎克雷伯菌(KP)为代表的革兰阴性菌是血流感染的主要病原体,在中国由大肠埃希菌和肺炎克雷伯菌引起的血流感染超过50%。
随着抗菌药物的广泛应用,碳青霉烯耐药肠杆菌科细菌(CRE)流行与耐药形势严峻。碳青霉烯类耐药肺炎克雷伯菌(CRKP)是CRE血流感染的主要致病菌,长期处于高水平流行状态,耐药性日趋严重,并伴有较高的病死率。在中国CRKP在CRE分离株中的占比为60%~90%,由于多重耐药菌株的快速传播、高死亡率以及缺乏有效的抗菌药物,CRKP所致BSI在临床治疗方面极具挑战。
当前对CRKP的鉴定主要采用传统的药敏试验,但非常耗时,需要数天甚至数周,容易延误临床治疗的时机,因此,探索一种快速检测CRKP的新方法具有重要的临床意义。
研究成果
近日,南昌大学第二附属医院检验科胡龙华教授团队基于气相色谱-离子迁移谱联用(GC-IMS)技术,通过测定CRKP和碳青霉烯类抗生素敏感的肺炎克雷伯菌(CSKP)在血培养过程中产生的代谢性挥发性有机化合物(VOCs)的特异性改变,实现了对CRKP的快速鉴定,其研究成果发表在应用微生物领域专业期刊AMB Express上(图 1),为临床微生物快速鉴定和药敏试验提供了一个新思路。

图 1 论文《GC-IMS技术助力在模拟血培养中耐碳青霉烯类肺炎克雷伯菌的鉴定》
胡龙华教授团队基于KP的4种标准菌株和69株临床分离株展开研究,使用相同的血培养条件,所有菌株产生的VOCs分别在气相色谱离子迁移谱联用仪(FlavourSpec®)上检测,为了观察亚胺培南(IPM,一种碳青霉烯类抗生素,具有超广谱、高效能的抗菌活性,对多种病原体所导致的中重度混合感染有明显的抗菌作用)对CSKP和CRKP的作用,标准菌株在血培养3h后分别加入终浓度为0.25mg/mL的IPM,并设置4个连续的时间点分别对菌液进行VOCs的检测。同时为了探索鉴定产碳青霉烯酶(CBPM)的KP,对CRKP各亚型加入CBPM抑制剂进行研究。相关的实验流程图详见图 2:
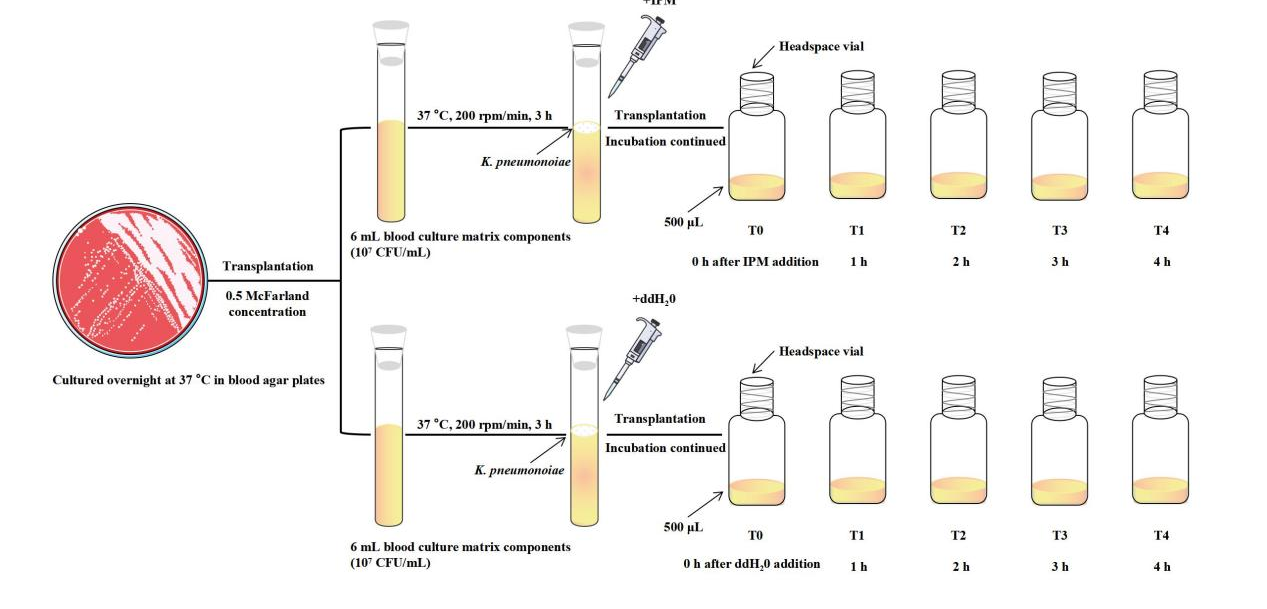
图 2 实验研究流程图
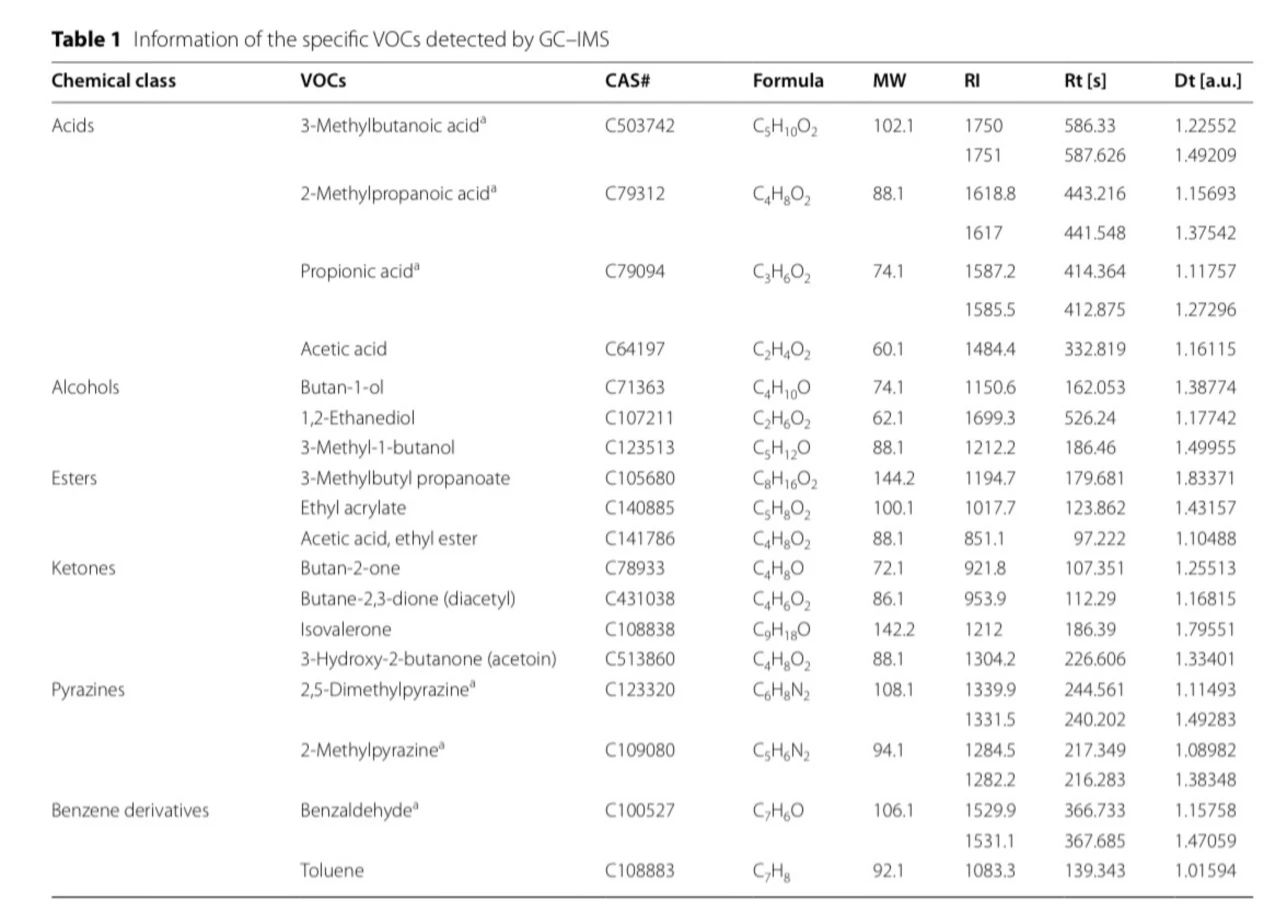
经过细菌培养和检测,总共检测出54种VOCs(其中6种VOCs同时检测到单体和二聚体),包括4种有机酸、3种醇、3种酯、4种酮、2种吡嗪、2种苯衍生物和30种未定性VOCs。可定性VOCs详见表 1,同时发现KP在培养5h后达到指数生长期的终点,后续时间点其VOCs的变化不明显,因此相应的研究实验均在5h(T2)时间点开展。
表 1 KP血培养种检测到的可定性VOCs
在CRKP和CSKP的鉴定中,在不添加IPM的条件下,通过检测标准菌株的VOCs,发现5种VOCs在两个组别种存在显著性差异,相对于CSKP,CRKP的未定性物质3#、21#、28#和正丁醇含量增加,而未定性物质30#含量减少(图 3)。之后主成分分析显示上述5种VOCs可有效地区分CSKP和CRKP(图 4),但这一差异会随着时间推移而消失。
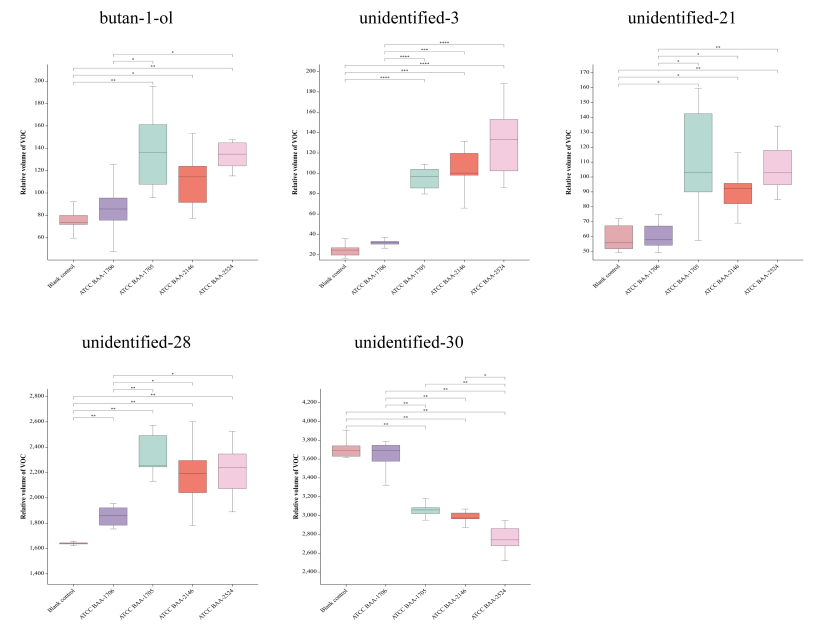
图 3 检测到的5种VOCs在CSKP和CRKP组间的含量差异
(ATCC BAA-1706为CSKP标准菌株,ATCC BAA-1705/2146/2524为CRKP标准菌株)
为了进一步探究IPM对KP的生长代谢以及释放的VOCs的影响,在标准菌株培养3h(T0时间点)后,加入终浓度0.25mg/mL的IPM,并在后续时间点检测对应的VOCs。结果发现CRKP组的VOCs和未加入IPM前保持了相同的变化趋势,而CSKP组的VOCs变化较为明显,相对于CSKP组,CRKP组的3-甲基丁酸(单体、二聚体)、2-甲基丙烯酸(单体、二聚体)、乙酸、丁二酮和3-羟基-2-丁酮的含量显著升高,而苯甲醛二聚体和丁酮的含量显著降低。同时在未定性的物质中,11种VOCs存在上升的趋势,而2种VOCs存在下降的趋势(图 5)。
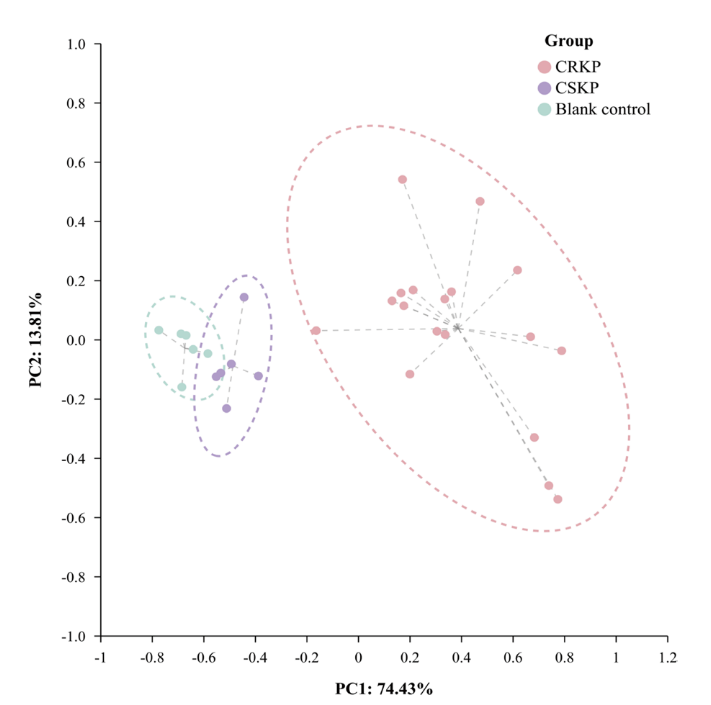
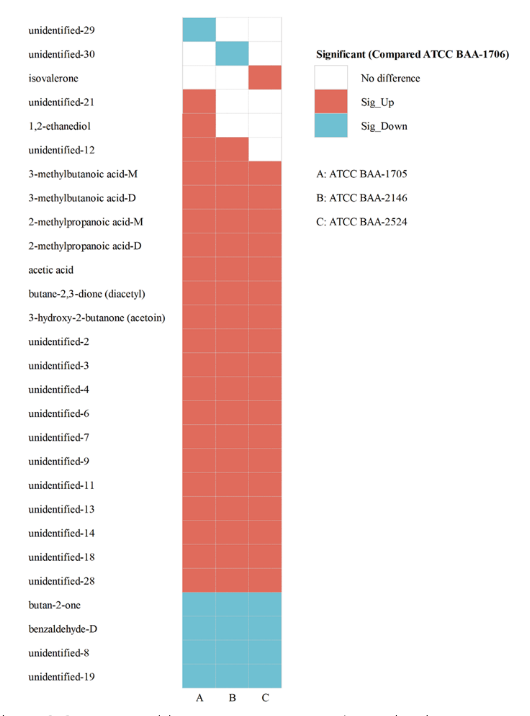
图 4 CSKP和CRKP的PCA图(未加入IPM) 图 5 CRKP组VOCs相对于CSKP组的变化(加入IPM后)
在CRKP中,最为常见的是产CBPM的KP,为研究VOCs的检测是否有助于鉴定产CBPM的CRKP,在标准菌株中加入IPM的同时,分别设置加入/不加入CBPM抑制剂进行对照研究,并在后续的时间点观察VOCs的变化情况。以产A类碳青霉烯酶KP为例,结果表明,ATCC BAA-1705菌株在加入CBPM抑制剂后,和未加入CBPM抑制剂相比,出现了5种VOCs(苯甲醛二聚体、2,5-二甲基吡嗪二聚体、2-甲基吡嗪二聚体、丁酮和未定性VOCs15#)含量的上升以及13种VOCs(2-甲基丙烯酸单体和二聚体、丙酸单体和二聚体、乙酸、3-羟基-2-丁酮和7种未定性物质)含量的下降(图 6)。通过PCA分析显示CBPM抑制剂的加入可鉴定ATCC BAA-1705为A类产CBPM的CRKP(图 7)。与之相似的是,加入CBMP抑制剂后,产B类碳青霉烯酶KP(ATCC BAA-2146)的VOCs发生了特异性改变。
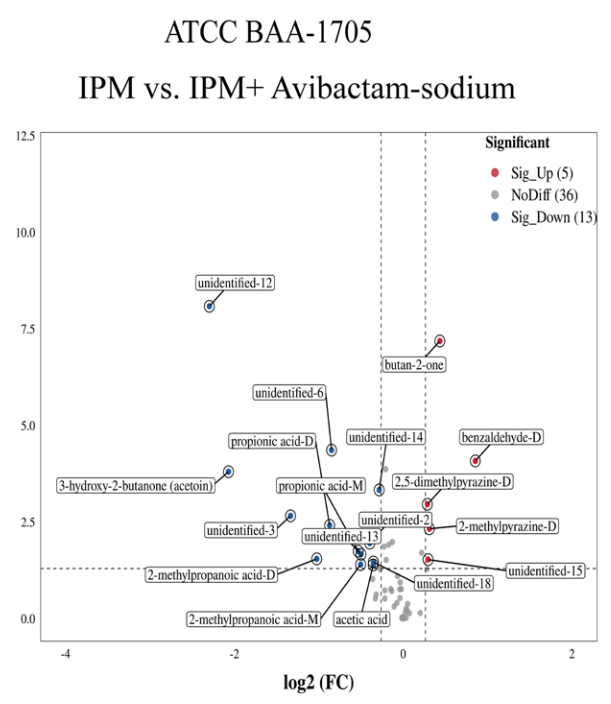
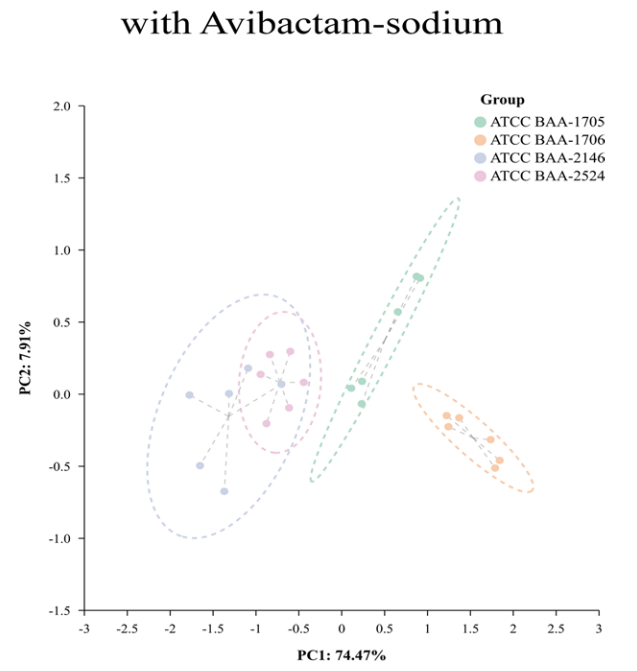
图 6 ATCC BAA-1705菌株加入CBPM抑制剂后的VOCs变化 图 7 加入CBPM抑制剂后的标准菌株VOCs的PCA图
针对临床分离的菌株,也先后通过加入IPM进行了CRKP的研究,以及加入CBPM抑制剂进行对产CBPM的CRKP的鉴定探索。本次研究涉及69例临床分离株,其中25例CSKP和44例CRKP,在44例CRKP中,包含20例KPC阳性株、15例NDM阳性株、4例IPM阳性株和5例CBPM阴性株。
加入IPM后,相对于CSKP,各亚型的CRKP均出现了部分VOCs的显著性变化(表 2,图 8)。结果表明IPM的加入可有效地鉴定产CBPM的CRKP,包括KPC阳性菌株、NDM阳性菌株和IPM阳性菌株。
表 2 CRKP临床分离株加入IPM后相对于CSKP的VOCs变化
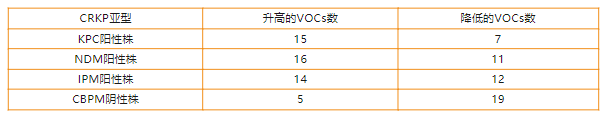
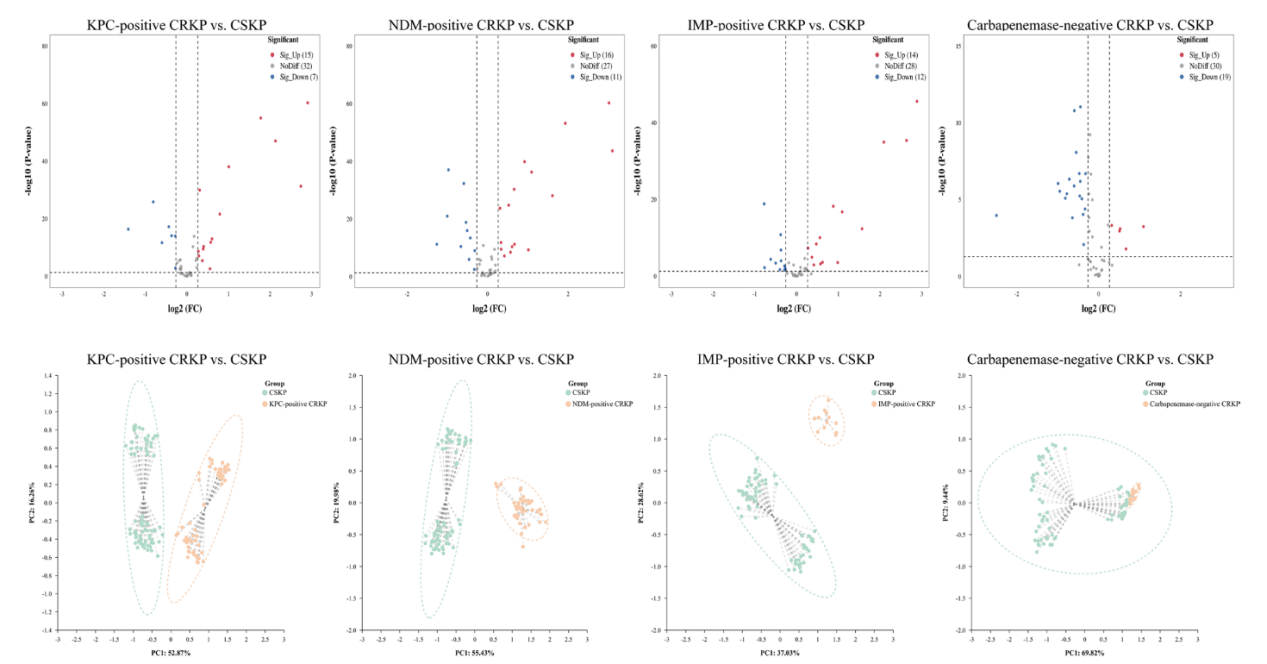
图 8 加入IPM后各亚型CRKP产生的VOCs的变化(相对于CSKP)
针对临床分离株,通过VOCs的检测鉴定产CBPM的CRKP,同标准菌株同样的实验操作方法,以加入B类酶抑制剂(DPA)为例,在T2时间点对VOCs进行检测,结果发现在加入DPA后,部分VOCs出现了显著的变化,包括KPC阳性株出现了4种VOC的升高和8种VOCs的降低;NDM阳性株出现了8种VOCs的升高和11种VOCs的降低;相比于NDM阳性株,IPM阳性株出现了1,2-乙二醇的升高和3-羟基-2-丁酮以及4种未定性VOCs的降低(图 9)。
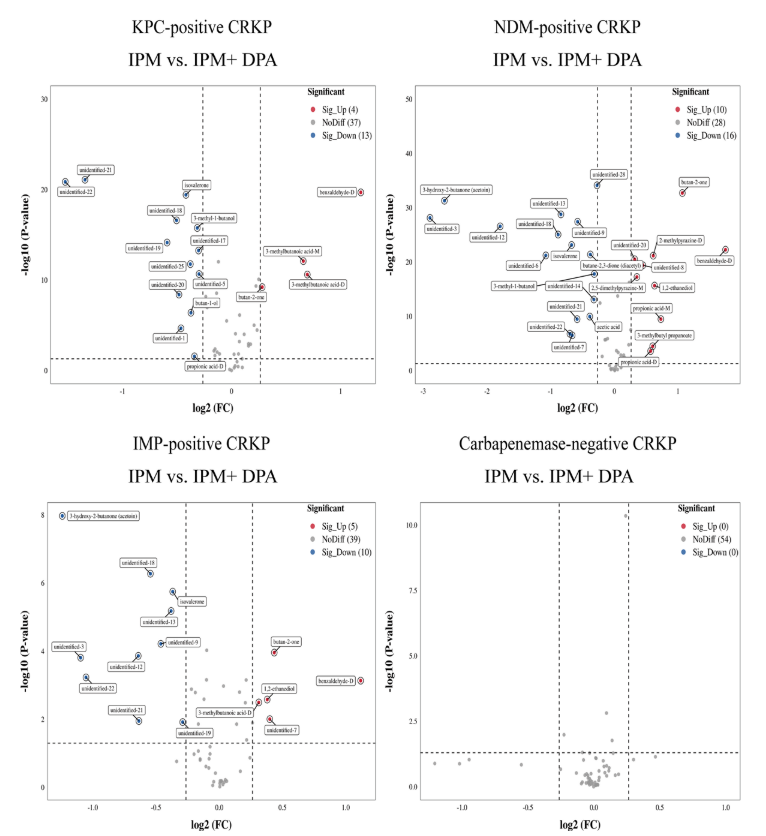
图 9 临床分离株加入IPM和CBPM抑制剂后的VOCs的变化情况
综上所述,本研究得到以下的结果:①通过血培养瓶中VOCs的相对组分检测,可实现对KP的鉴定。②在加入IPM后,CSKP和CRKP释放的VOCs的差异得到了进一步证实,从而发现了识别和鉴定CRKP的潜在VOCs指标。③CBPM抑制剂的加入使相应菌株中特异性VOCs的组成发生了明显的变化,从而为CBPM表型的检测提供了一种新的方法,为临床引起BSI常见的KP的鉴定和耐药性评估开辟一种快速的新方法。针对上述的研究结果,后续有待于进一步深化研究,开展更大规模的临床多中心验证以及前瞻性研究。
关于GC-IMS技术
气相色谱-离子迁移谱联用(GC-IMS)技术是将气相色谱的高效分离与离子迁移谱的痕量快速分析优势相结合,经过二次分离后得到保留时间、漂移时间和信号强度的三维谱图,实现对各类样品中VOCs的痕量检测,目前广泛应用于风味、泛环境和医学检测领域的研究。设备具有高灵敏度、适应性强、操作简便、快速分析的特点,相关的检测流程示意图详见图 10,本研究对于KP产生的VOCs的检测操作均在气相色谱离子迁移谱联用仪(FlavourSpec®)上完成。
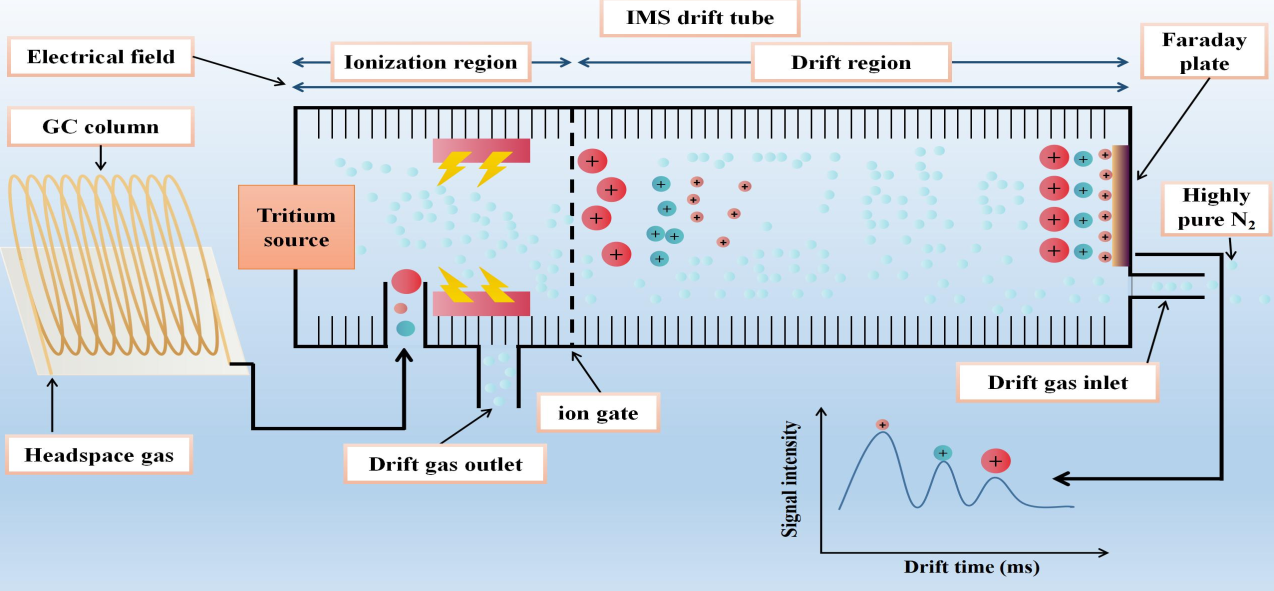
图 10 GC-IMS检测原理流程示意图
















